Função da Química Inorgânica
As substâncias inorgânicas se dividem em
quatro grandes grupos que são conhecidos como as funções da química inorgânica.
São elas: ácidos, bases, óxidos e sais.
Ácidos: São substâncias que
ao entrar em contato com água sofrem ionização e produzem o íon positivo H+ e
o íon negativo do outro elemento.
HCl + H2O →
H+ + Cl-
HF + H2O →
H+ + F-
Sendo assim, a característica dos
ácidos é a presença do cátion H+ e o que varia, de um
ácido para outro, é o ânion.
HCl
H3PO4
HBr
H2S
HNO3
HF
As principais características dos
ácidos são:
- sabor azedo (em geral tóxicos e corrosivos);
- conduzem eletricidade em solução aquosa (em água);
- mudam a cor de certas substâncias (indicadores
ácido-base, que são substâncias orgânicas);
- reagem com base formando sal e água
Bases: São substâncias que em água
sofrem dissociação e produzem como íon negativo apenas OH- e
tornam o outro elemento um íon positivo.
NaOH + H2O →
Na + OH-
KOH + H2O →
K + OH-
Dessa forma concluímos que para uma
substância ser considerada uma base ela deve possuir em sua estrutura a hidroxila,
isto é, o grupo OH-
Al(OH)3
Ca(OH)2
pH: Como os ácidos se ionizam
em íons hidrogênio (H+) e as bases em íons hidróxido (OH–), conclui-se
que, quanto mais íons hidrogênio houver em uma solução, mais ácida ela
será. Alternativamente, quanto mais íons hidróxido houver em uma solução,
mais básica ela será. É possível medir a concentração de hidrogênio iônico
em uma solução a partir de uma escala logarítmica inversa, que
recebeu o nome de potencial hidrogeniônico, ou simplesmente, escala
de pH.
Esta escala vai de zero a 14, sendo o pH 7 considerado
neutro. Os valores menores que sete classificam a solução medida como ácida e
os maiores que sete, como bases.
Sais:
São compostos iônicos que em água se dissociam
num cátion diferente de H+ e um ânion diferente
de OH-. Eles são tipicamente o produto de
uma reação química entre:
Uma base e um ácido:
forma-se um sal e água. Por exemplo:
2NaOH + H2SO4 + 2H2O
Óxidos: São compostos químicos binários formado por átomos de
oxigênio com outro elemento, exceto flúor, em que o oxigênio é o mais
eletronegativo.
NO
CO2
SO3
Cl2O7
Na2O CaO
Notação Científica
Unidade de Medida
Comprimento:
Massa:
Separação de misturas
Catação: usa a mão ou pinça para separar misturas de cores,
formatos e tamanho. Ex.: catar feijão.
Peneiração: Uso da peineira para separar o tamanho.
Levigação: Uso da água (em movimento) para separar por
densidade. Ex.: Bateia em movimento com água separa a
água do ouro (Mariana).
Ventilação: Usa o vento para separar densidades diferentes. Ex.:
Ventilador tirando a casca do arroz.
Separação Magnética: Usa o imã para separar o ferro do
restante. Ex.: Porquinhas dentro da caixa de
ferramentas.
Dissolução fracionada: Ex.: Sal +
Areia. Adiciona água, separando a areia e ficando sal + água (utiliza-se a
evaporação e fica somente com o sal)
Filtração: Usa-se o filtro para
separar substancias de tamanhos diferentes.
Evaporação: Aquece uma substancia e não obtém o material mais volátil.
Decantação: - Densidade diferente
- Insolúvel
Centrifugação: Usa-se o centrifuga, acelera a decantação, densidades
diferentes e substancias insolúveis.
Destilação Simples: P.E.
distintos.
Destilação fracionada: 2 ou +
líquidos com P.E. diferentes, porem próximos.
Fusão fracionada: 2 ou + sólidos
com P.F. diferentes. Ex.: Liga metálica.
Gabarito:
A
D
F v v f v
D
B
A
E
C
D
C
Exercícios para praticar !
1- (PUC-SP) Considere o gráfico abaixo:
As curvas AA e BB, correspondem respectivamente, ao comportamento de:
a) uma substância pura e uma solução.
b) uma solução e uma substância pura.
c) uma mistura homogênea e uma mistura heterogênea.
d) duas soluções.
e) duas substâncias puras
2- (Unitau-SP) Misturas azeotrópicas são:
a) misturas heterogêneas com ponto de fusão constante.
b) misturas homogêneas ou ligas de ponto de fusão constante.
c) líquidos ou ligas de ponto de fusão constante.
d) soluções líquidas de ponto de ebulição constante.
e) líquidos de ponto de ebulição variável.
3-(UNICAP-PE)(MODIFICADA)
As seguintes afirmativas referem-se a substâncias puras.Julgue como verdadeira ou falsa:
0 -A água do mar é uma substância pura.
1 -O bronze (liga de cobre e estanho) é uma mistura.
2 -O etanol é uma substância pura.
3 -O oxigênio é uma mistura.
4 -O ar é, praticamente, uma mistura de oxigênio e nitrogênio
4-(FEI-SP) Qual das alternativas abaixo contém somente substâncias simples?
a) H2O, HCℓ, CaO
b) H2O, Au, K
c) H2O, Cℓ2, K
d) Au, Fe, O2
e) H2, Cℓ2, NaCℓ
5-(FURG-RS) Considerando o diagrama abaixo, onde cada esfera representa um átomo, e esferas diferentes representam átomos diferentes, julgue as afirmativas.
I. Existem apenas dois elementos químicos
representados no sistema.
II. O sistema representa uma amostra de três
substâncias.
III. Encontram-se representadas apenas moléculas de
substâncias simples.
IV. Uma das substâncias representadas pode ser
ozônio.
V. O diagrama possui sete moléculas representadas.
São verdadeiras as afirmativas:
a) I, II e IV.
b) I, II e V.
c) II, III e V.
d) III, IV e V.
e) Apenas I e V.
6-(UNA-MG) Quantas substâncias são encontradas nos sistemas abaixo?
I) Álcool hidratado.
II) 3 cubos de gelo em água.
III) Glicose dissolvida em uma solução aquosa de cloreto de sódio.
Assinale a opção que indica o número correto de substâncias (respectivamente):
a) 2, 1 e 3
b) 1, 4, 3
c) 2, 1, 2
d) 3, 3, 1
e) 1, 2, 4
7-(ITA-SP) Num experimento, um estudante verificou ser a mesma a temperatura de fusão de várias amostras de um mesmo material no estado sólido e também que esta temperatura se manteve constante até a fusão completa.
Considere que o material sólido tenha sido classificado como:
I. Substância simples pura
II. Substância composta pura
III. Mistura homogênea eutética
IV. Mistura heterogênea
8-As figuras a seguir constituem os sistemas fechados, nos quais as bolinhas representam átomos.
Considerando-se as ilustrações, as misturas são representadas por
a) I e II.
b) III e IV.
c) I, III e IV
d) II, III e IV.
9-(CFT-SC) Observe as figuras a seguir, onde os átomos são representados por esferas e cada tamanho representa um átomo diferente. Depois, assinale a alternativa VERDADEIRA:
a) Nas figuras 1 e 2 encontramos somente substâncias simples.
b) As figuras 1 e 3 representam misturas.
c) Na figura 2 estão representados 14 elementos químicos.
d) Durante uma mudança de estado físico, a temperatura permanece constante para as amostras representadas nas figuras 2 e 3.
e) Na figura 3 estão presentes 6 substâncias.
10-(UFES-ES) Uma mistura eutética é definida como aquela que funde à temperatura constante. O gráfico que melhor representa o comportamento dessa mistura até sua completa vaporização é:
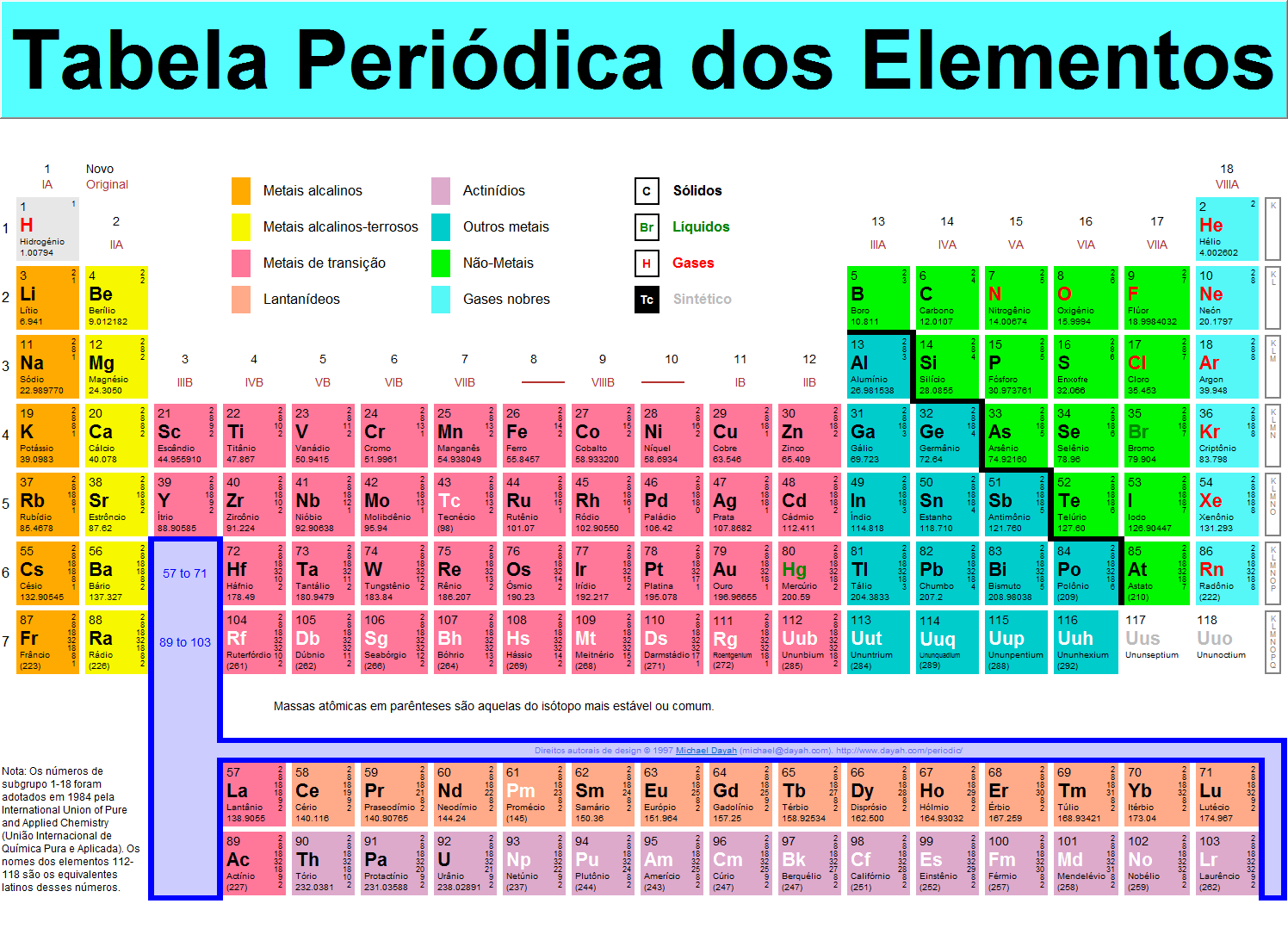
Tabela períodica
Dica: http://www.tabelaperiodicacompleta.com/
• Metais: Eles constituem a maioria dos elementos da tabela. São bons condutores de eletricidade e calor, são maleáveis e dúcteis, possuem brilho metálico característico e são sólidos, com exceção do mercúrio.
• Não-Metais: São os mais abundantes na natureza e, ao contrário dos metais, não são bons condutores de calor e eletricidade, não são maleáveis e dúcteis e não possuem brilho.
• Gases Nobres: São no total 6 elementos e sua característica mais importante é a inércia química.
• Hidrogênio: O hidrogênio é um elemento considerado à parte por ter um comportamento único.
Vídeo sobre modelos atômicos, átomos e ions.
Resumo sobre ligações químicas:
Substâncias puras e misturas
Resumo sobre ligações químicas:
Substâncias puras e misturas
· Substância
pura Simples: é aquela formada exclusivamente por
partículas (moléculas ou átomos) quimicamente iguais. Átomos de um elemento.
Ex: O²; N²; B¹²; H²...
· Substância
pura Composta: é aquela formada exclusivamente
por partículas (moléculas ou átomos) quimicamente iguais. Átomos de 2 ou mais elementos.
Ex: H²O; NaCl; C6H¹²O6...
Simples Composta
- Fases: propriedades semelhantes
Substância pura
1 estado físico: 1 fase. Ex: água
2 estados físicos: 2 fases. Ex: água + gelo
·
Mistura: duas ou mais substâncias
juntas. Deixam de ser substâncias puras e variam componentes da mistura.
Misturas são formadas por duas ou mais
substâncias e se classificam em homogênea ou heterogênea, dependendo da
natureza de seus constituintes, uma vez que toda mistura homogênea é uma solução.
A)
Homogênea: não
consigo distinguir as substâncias puras a olho nu ou com lentes. Contém 1 fase.
É uma solução.
Ex: Água
+ sal ; Água + álcool
B)
Heterogênea:
a
olho nu ou com lentes consigo distinguir as substâncias puras. Contém 1 ou +
fases.
Ex: Água
+ areia ; Água + óleo
Gráficos
substância pura x misturada
P.F e P.E constante
P.F e P.E variam
Misturas
Mistura Eutética. Ex: solda
P.E. : varia
Mistura Azeotrópica. Ex: água/álcool
P.F. = varia
Vídeo sobre Ligação Iônica
Vídeo sobre Ligação Covalente
RECUPERAÇÃO
Matéria : tudo
que tem volume ou massa
Massa: quantidade
de matéria que o corpo possui
Volume: espaço
ocupado pelo corpo
Átomo: pequenas
partículas que formam a matéria
Molécula: união
de átomos
Propriedade Geral da Matéria:
Inércia: capacidade de alterar o espaço onde
o corpo se encontra
Impenetrabilidade: dois corpos não ocupam o mesmo
espaço ao mesmo tempo
Divisibilidade: capacidade de dividir
Compressibilidade: capacidade de diminuir o volume
Elasticidade: Capacidade de voltar ao volume
inicial
Sólido
ganha calor para ir pro estado gasoso
Gasoso
perde calor para ir pro estado sólido
Ponto de
Fusão: é a temperatura que irá ocorrer a FUSÃO ou a SOLIDIFICAÇÃO.
Ponto de
Ebulição: é a temperatura que irá ocorrer a EBULIÇÃO ou a CONDENSAÇÃO.
Gráfico de mudança de Estado Físico
" Densidade é a medida da proximidade das partículas de uma determinada substância " (SCALABRINI, Felipe).
Roteiro de estudos para o Simulado
#Unidade 2:
As transformações dos materiais
Tema 01: A constituição da
matéria.
Caracterizar, localizar e calcular as sub partículas atômicas (prótons,
elétrons e nêutrons): Os prótons
são as sub partículas positivas que se localizam no núcleo do átomo, juntamente
com os nêutrons, que têm carga neutra. Já os elétrons são negativos e estão
localizados na eletrosfera.
Caracterizar átomo neutro e íons (cátions e ânions): Átomos neutros sõ aqueles que têm o número de prótons
igual ao número de elétrons. Na tabela periódica, todos os átomos são neutros
mas só os Gases Nobres são estáveis.
Além disso, átomos de um mesmo
elemento não variam quanto ao número de prótons.
Um átomo ion é quando ele ganha ou
perde elétrons, dessa forma, o número de prótons é diferente do de elétrons.
Isso acontece para que eles fiquem estáveis. Ele pode ser cátion ou ânion.
Cátion: quando perde
elétrons e fica com carga positiva.
Ânion: quando ganha elétrons e fica com
carga negativa.
Conceituar e calcular número atômico e
massa: O número atômico
(Z) é a quantidade de prótons que um átomo possui, ou seja, mesmo elemento
químico, mesmo número atômico.
A massa de um
átomo (A) está no núcleo.
Z + N = A Sendo N= nêutrons
Conceituar elemento químico e conhecer suas
representações: Elemento
químico é todo conjunto de átomos que possui o mesmo número atômico, ou seja,
mesmo número de prótons.
Ele pode ser
representado de maneiras diferentes, uma delas é utilizando somente as letras,
como os exemplos abaixo:
C - Carbono
Ca - Cálcio
He - Hélio
S - Enxofre etc.
Pode-se utilizar a seguinte representação também, sendo X um elemento
qualquer:
Conceituar, aplicar e diferenciar elementos isótopos: São átomos de um mesmo elemento químico
mas com núcleos diferentes, eles têm o mesmo número de prótons porém o número
de nêutrons é diferente. Os isótopos de um elemento são identificados pelo número
(A) de massa.
Reconhecer e conhecer as famílias e os períodos: As famílias são as linhas verticais e se
assemelham pela quantidade de elétrons na última órbita. Da 3 à 12 não há um
padrão.
Nomes:
1 Metais alcalinos
(exceto hidrogênio)
2 Metais alcalinos
terrosos
3-12 Elementos de
transição
13 Família do Boro
14 Família do Carbono
15 Família do Nitrogênio
16 Calcogênio
17 Halogênio
18 Gases nobres
Já os períodos são as
linhas horizontais na tabela periódica e ao longo deles o número atômico vai
aumentando. O período indica o número de órbitas.
Reconhecer o número atômico como critério básico da classificação
periódica moderna: A tabela
atual é a de Monsely, na qual os elementos estão na ordem crescente de número
atômico.
Identificar os símbolos de elementos mais comuns na
tabela periódica e Classificar e caracterizar os elementos em: Metal, Ametal e
Gases nobres: Ver
tabela periódica mais abaixo.
(Não é o roteiro completo)
Ligação química
Para que um átomo fique estável são necessários 8 elétrons na última órbita. É a regra do octeto. Como toda regra à sua exceção, o H (Hidrogênio), He (Hélio), Li (Lítio), Be (Berílio), B (Boro) precisam de somente 2 elétrons para ficarem estáveis pois têm somente 1 órbita.
A valência de um átomo é o número de elétrons que ele pode ganhar ou perder.
Família
Valência
1
+1
2
+2
13
+3
14
+4 ou -4
15
-3
16
-2
17
-1
Família
Valência
1
+1
2
+2
13
+3
14
+4 ou -4
15
-3
16
-2
17
-1
Ao analisar a tabela é possível perceber que a valência varia de acordo com a família, ou seja, com o número de elétrons na última órbita.
è Ligação iônica
Metal: Facilidade para perder elétrons (cátion +)
Ametal: Facilidade para ganhar elétrons (ânion -)
o É a ligação entre os metais e ametais.
o A quantidade de elétrons doados = a quantidade de elétrons recebidos.
Fórmulas
Iônica: Na+1Cl-1
Mínima: NaCl
Obs.: Na hora de escrever a fórmula o metal sempre vem antes do ametal.
Importante!
o Elétrons são tranferidos formando cátions e ânions. A ligação formada é um retículo cristalino.
o Altos P.F. e P.E.
o Conduzem corrente elétrica somente no estado líquido, NÃO no sólido.
o Em condições ambientais são sólidos.
o Acontece entre ametal e ametal.
o Os átomos se unem por compartilhamento de elétrons, formando móleculas.
Fórmulas:
1) Molecular: O2 H2O
2) Eletrônica: (3) (1)

3) Estrutural:
Importante!
o Os átomos NÃO doam nem recebem elétrons, eles compartilham.
o Estão nos 3 estados físicos.
o P.F. e P.E. são baixos.
o NÃO conduzem corrente elétrica.
(Registro passado em sala. Resumos e questões para o simulado serão postados depois.)
___________________________________
Tabela Periódica
Mendeleev: foi usada de 1869 a 1871, foi a primeira tabela periódica e ela é organizada em ordem crescente de massa.
Mosely: é a tabela atual, ela é organizada em ordem crescente de numero atômico, ocorrendo regularidade entre as propriedades dos elementos.
- Todos os elementos da tabela são neutros.
- Linhas horizontais são chamadas de períodos e ao longo deles o número atômico aumenta. Eles indicam o número de órbitas.
- As linhas verticais, chamadas de família, possuem propriedades semelhantes como a última órbita com a mesma quantidade de elétrons.
- A partir do número atômico 95 são elementos artificiais produzidos em laboratório.
Metais x Ametais
Pouca reação com oxigênio
|
Muita reação como oxigênio
|
Tem brilho
|
Não tem brilho
|
São sólidos, exceto mercúrio.
|
Alguns sólidos, gasosos e líquidos
|
Ponto de fusão maior que 25° (alto)
|
Ponto de fusão baixo
|
Ponto de ebulição de acordo com a temperatura do ambiente
|
Ponto de ebulição baixo
|
São duros mas maleáveis
|
Quebram facilmente
|
Conduzem bem a eletricidade e o calor
|
Não conduzem bem o calor e nem a eletricidade
|
Densidade
A densidade é uma grandeza que expressa a razão entre a massa de um material e o volume por ele ocupado.
 |
| (A diferença de densidade é a propriedade que mantém os líquidos da figura separados). |
A densidade é uma propriedade específica de cada material que serve para identificar uma substância. Essa grandeza pode ser enunciada da seguinte forma:
A unidade de densidade no SI é o quilograma por metro cúbico (kg/m3), embora as unidades mais utilizadas sejam o grama por centímetro cúbico (g/cm3) ou o grama por mililitro (g/mL). Para gases, costuma ser expressa em gramas por litro (g/L).
Conforme se observa na expressão matemática da densidade, ela é inversamente proporcional ao volume, isto significa que quanto menor o volume ocupado por determinada massa, maior será a densidade. Para entendermos como isso se dá na prática, pense, por exemplo, na seguinte questão: o que pesa mais, 1 kg de chumbo ou 1 kg de algodão?
Na realidade, eles possuem a mesma massa, portanto, o “peso” deles é o mesmo. Porém, a diferença consiste na densidade, pois 1 kg de chumbo se concentra em um volume muito menor que 1 kg de algodão. A densidade do algodão é pequena, porque sua massa se espalha em um grande volume.
Desse modo, vemos que a densidade de cada material depende do volume por ele ocupado. E o volume é uma grandeza física que varia com a temperatura e a pressão. Isso significa que, consequentemente, a densidade também dependerá da temperatura e da pressão do material.
Um exemplo que nos mostra isso é a água. Quando a água está sob a temperatura de aproximadamente 4ºC e sob pressão ao nível do mar, que é igual a 1,0 atm, a sua densidade é igual a 1,0 g/cm3. No entanto, no estado sólido, isto é, em temperaturas abaixo de 0ºC, ao nível do mar, a sua densidade mudará – ela diminuirá para 0,92 g/cm3.
Note que a densidade da água no estado sólido é menor que no estado líquido. Isso explica o fato de o gelo flutuar na água, pois outra consequência importante da densidade dos materiais é que o material mais denso afunda e o menos denso flutua.
Para compararmos essa questão, veja a figura abaixo, na qual temos um copo com água e gelo e outro copo com uma bebida alcoólica e gelo:
Observe que o gelo flutua quando colocado na água e afunda quando colocado em bebidas alcoólicas. A densidade é a grandeza que explica esse fato. Conforme já dito, a densidade do gelo (0,92 g/cm3) é menor que a da água (1,0 g/cm3); já a densidade do álcool é de 0,79 g/cm3, o que significa que é menor que a densidade do gelo, por isso o gelo afunda.
Outra questão que pode ser observada na ilustração é que o gelo não fica totalmente acima da superfície da água. Isso ocorre porque, comparando a densidade do gelo com a da água, podemos calcular pela diferença entre elas que é necessário apenas 92% do volume do gelo para igualar a massa de água que ele desloca. Dessa forma, 92% do volume do gelo fica abaixo da superfície da água; e apenas 8% fica acima da superfície. É por isso que os icebergs são tão perigosos para a navegação.
É em razão disso que várias espécies animais e vegetais sobrevivem, pois em épocas frias a água da superfície de mares e lagos se congela. Quando a temperatura aumenta, esse gelo derrete. No entanto, se o gelo formado afundasse, ficando no fundo dos lagos e mares, o resultado seria que dificilmente esse gelo derreteria e em pouco tempo as vidas das espécies nessas regiões estariam comprometidas.
A seguir temos as densidades de algumas substâncias do nosso cotidiano:
Leite integral...........................1,03 g/cm3
Alumínio ................................ 2,70 g/cm3
Diamante .................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Mercúrio .................................13,6 g/cm3
Fonte: www.brasilescola.com
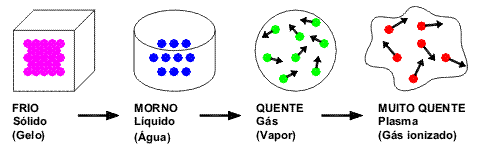
Estados físicos da matéria
Quando nos referimos à água, a ideia que nos vem de imediato à mente é a de um líquido fresco e incolor. Quando nos referimos ao ferro, imaginamos um sólido duro. Já o ar nos remete à ideia de matéria no estado gasoso.
Toda matéria que existe na natureza se apresenta em uma dessas formas - sólida, líquida ou gasosa. É o que chamamos de estados físicos da matéria.
No estado sólido, as moléculas de água estão bem "presas" umas às outras e se movem muito pouco: elas ficam "balançando", vibrando, mas sem se afastarem muito umas das outras. Não é fácil variar a forma e o volume de um objeto sólido, como a madeira de uma porta ou o plástico de que é feito uma caneta, por exemplo.
O estado líquido é intermediário entre o sólido e o gasoso. Nele, as moléculas estão mais soltas e se movimentam mais que no estado sólido. Os corpos no estado líquido não mantém uma forma definida, mas adotam a forma do recipiente que os contém, pois as moléculas deslizam umas sobre as outras. Na superfície plana e horizontal, a matéria, quando em estado líquido, também se mantém na forma plana e horizontal.
No estado gasoso a matéria está muito expandida e, muitas vezes, não podemos percebê-la visualmente. Os corpos no estado gasoso não possuem volume nem forma próprios e também adotam a forma do recipiente que os contém. No estado gasoso, as moléculas se movem mais livremente que no estado líquido, estão muito mais distantes umas das outras que no estado sólido ou líquido, e se movimentam em todas as direções. Frequentemente há colisões entre elas, que se chocam também com a parede do recipiente em que estão. É como se fossem abelhas presas em uma caixa, e voando em todas as direções.
Em resumo: no estado sólido as moléculas de água vibram em posições fixas. No estado líquido, as moléculas vibram mais do que no estado sólido, mas dependente da temperatura do líquido (quanto mais quente, maior a vibração, até se desprenderem, passando para o estado gasoso, em um fenômeno conhecido como ebulição). Consequentemente, no estado gasoso (vapor) as moléculas vibram fortemente e de forma desordenada.
Fonte: www.sobiologia.com.br
Calor e Temperatura
Átomo
O que é um Átomo?
Todas as substâncias são feitas de matéria e a unidade fundamental da matéria é o átomo. O átomo constitui a menor partícula de um elemento que participa em reações químicas e pode ou não existir de maneira independente.
O que é a Estrutura de um Átomo? O histórico da descoberta da estrutura atômica está delineado abaixo.
- John Dalton (1808) propôs a Teoria Atômica. De acordo com Dalton, a matéria é constituídade partículas minúsculas chamadas átomos. O átomo é a menor partícula de um elemento que participa em uma reação química. Átomos são indivisíveis e não podem ser criados ou destruídos. Além disso, átomos de um mesmo elemento são idênticos em todos os aspectos.
J. J. Thomson (1897) descobriu os elétrons em experimentos do Raio Catodo. Para Thomson, os átomos são divisíveise. Átomo contêm minúsculas partículas com carga negativa chamadas elétrons.
E. Rutherford (1911) descobriu o núcleo e propôs a base para a estrutura atômica moderna através de seu experimento do desvio da partícula alfa. Para Rutherford, os átomos são compostos de duas partes: o núcleo e a parte extra-nuclear. Seus experimentos provaram que o átomo é amplamente vazui e que possui um corpo altamente carregado positivamente em seu centro chamado núcleo. O núcleo central é carregado positivamente e os elétrons, com carga negativa, revolvem ao redor do núcleo.
N. Bohr (1940) propôs o conceito moderno do modelo atômico. Para Bohr, o átomo é feito de um núcleo central contendo prótons (com carga positiva) e nêutrons (sem carga). Os elétrons (com carga negativa) revolvem ao redor do núcleo em diferentes trajetórias imaginárias chamadas órbitas.
O que é Número Atômico e Peso Atômico?
- Número Atômico de um elemento é o número de prótons no núcleo de um átomo. Como os átomos são elétricamente neutros, o número de prótons é igual ao número de elétrons.
- Peso Atômico (ou massa atômica relativa) de um elemento é o número de vezes que um átomo daquele elemento é mais pesado que um átomo de hidrogênio. O peso atômico do hidrogênio é considerado como a unidade [1].
- Número de Massa de um elemento é a soma do número de prótons e nêutrons no núcleo de um átomo.
1) Com o objetivo de testar a eficácia de uma nova vacina contra febre aftosa, vacinou-se um lote de vinte vacas, deixando outras vinte sem vacinar. Após algum tempo, injetou-se em todas as vacas o vírus causador da febre aftosa. Qual é a FUNÇÃO do lote não-vacinado? JUSTIFIQUE.
2) Veja a seguinte afirmativa de um aluno: “1 kg de algodão tem maior massa quando comparado com 1 kg de chumbo.” COMENTE essa afirmativa.
3) Preencha a tabela abaixo:
Observa o esquema a seguir e responda as questões 4 até 6.
4) PREENCHA com: Sublimação, fusão, condensação, solidificação, sublimação e vaporização.
5) INDIQUE o sentido onde está havendo ganho e perda de calor.
6) De maneira completa e científica COMENTE sobre o que ocorre com as partículas quando elas passam a perder calor.
7) O gráfico representa a fusão de uma substância pura chamada fenol ao nível do mar.
a) QUAL o estado físico do fenol a 38 ºC? E a 55 ºC? JUSTIFIQUE sua resposta.
b) QUANTOS minutos durou a fusão?
c) Com base no gráfico, RELACIONE temperatura com a agitação das partículas.
8) O QUE ACONTECERIA com o gráfico da questão 7, se esta substância fosse fundida no pico da neblina a 2.994 metros de altitude? JUSTIFIQUE.
9) O milho de pipoca afunda na água, enquanto a pipoca flutua.De acordo com seus conhecimentos sobre densidade explique o POR QUÊ isso acontece?
10) Um professor apresenta para seus alunos 3 cubos metálicos de 8 cm3 e informa que eles são feitos de chumbo, cobre e ferro, de densidades: 11,3 g/cm3, 9,0g/cm3 e 7,9g/cm3 respectivamente.
a) Considerando que os três cubos apresentam o mesmo volume, INDIQUE qual deles possui maior massa. JUSTIFIQUE.
b) CALCULE a massa de cada cubo.
11) Veja o gráfico abaixo:
a) QUAL substância A ou B é mais densa?JUSTIFIQUE.
b) CALCULE o volume que 12 g da substância A ocupa.
c) Numa mesma massa, QUAL substância possui maior volume? JUSTIFIQUE.
Veja a representação abaixo e responda as questões 12,13 e 14.
12) IDENTIFIQUE o cientista que realizou esse experimento.
13) CITE as conclusões que o cientista do esquema acima chegou.
14) QUAIS foram os cientistas que foram contrariados por este sujeito e QUAIS eram suas teorias.
15) Com base nos modelos atômicos de Dalton e de Thomson CITE diferenças e semelhanças entre eles.
Analise a figura abaixo e respondas as questões 16, 17 e 18
16) A figura representa um átomo nos moldes do modelo atômico atual e sabendo que o átomo contenha 4 nêutrons um cientista concluiu que a figura na verdade se trata não de um átomo, mas de um íon. Utilizando-se unicamente daquilo que se pode ver na figura, JUSTIFIQUE a conclusão do cientista.
17) CALCULE o número atômico e a massa desse átomo.
18) DETERMINE a semelhança e a diferença entre o átomo representado acima e o seu isótopo?
19) O iodo (do grego iodés, cor violeta) é um elemento químico de símbolo I , de número atômico 53 e de massa atômica 127. O íon I – é indispensável para produção de certos hormônios da glândula tireóide, por isso é prescrito por leaincorporaçãodeste componente no sal de cozinha que é vendido nos supermercados. INDIQUE o nome desse íon e CALCULE o número de prótons, elétrons e nêutrons.












.jpg)
.jpg)
.jpg)













.jpg)

.jpg)